
기출
중유의 조성이 C 78%, H 15%, O 2%, 기타 5%일 때 이론 공기량N㎥/kg을 구하시오.
A0 = 8.89C + 26.67 x (H- O/8) + 3.33S
= 8.89 x 0.78 + 26.67 x (0.15 - 0.02/8)=10.87 N㎥/kg

[보기]와 같은 중량 비율을 갖는 액체연료를 완전 연소할 때의 물음에 답하시오.
[보기] 탄소(C) : 75 %, 수소(H): 15%, 산소(O): 5%, 황(S): 3%, 기타: 2%
(1) 이론공기량[ N㎥/kg] 계산하시오.
A0=8.89C+26.67(H-O/8)+3.33
= 8.89x0.75+26.67x(0.15-0.05/8)+3.33x0.03 = 10.6 N㎥/kg
(2) 이론습배기 가스량 [ N㎥/kg] 계산하시오.
G0w=8.89C + 32.3H - 2.63O + 3.33S + 0.8N + 1.244W
= 8.89 x 0.75 + 32.3 x 0.15 - 2.63 x 0.05 + 3.33 x 0.03 = 11.48 N㎥/k

탄소 72%, 수소5.3%, 황0.4%, 산소8.9%, 질소1.5%, 수분0.9%, 회분11.0%의 조성을 갖는 석탄의 고위 발열량kcal/kg은 얼마인가?


황(S) 1kg/s을 연소시켰을 때 배기 가스량 N ㎥/s 을 계산하시오.

이론 공기량
32kg : 22.4 N㎥ = 1kg : x O N㎥ ∴ A0 =O/0.21 = (1 x 22.4)/(32 x 0.21) =3.33 N ㎥/kg
SO2 량
32kg : 22.4 N㎥ = 1kg : x SO2 N㎥ ∴ SO2량 = (1 x 22.4)/32 =0.7 N ㎥/kg
배기 가스량 (공기중 질소N2의 체적비율은 79%이다)
G0 = 질소가스량 + SO2량 = {(1-0.21) x A0} + SO2 량
= {(1-0.21)x3.33}+0.7=3.33 N ㎥/s

에틸렌(C2H4)10g을 완전 연소시킬 때 380g의 공기가 소요되었다면 과잉공기량g은 얼마인가?


연료 1kg당 소요 이론공기량이 10.5N㎥, 이론 배기가스량이 11.5 N㎥ 공기비가 1.4일때 실제 배기가스량은 몇 N ㎥/kg 인가? => Gd = 이론배기가스량+과잉공기량
= 이론배기가스량+(m-1)xA0 = 11.5+(1.4-1) x 10.5 =15.7 N㎥/kg

프로판 1 S㎥를 공기 중에서 완전 연소 시 수증기를 포함한 이론 연소가스량 S㎥/ S㎥계산하시오.(단, 공기조성은 체적으로 질소 79%, 산소21%이다.)

= 25.81 S㎥/ S㎥

분자기호가 C1.16H4.32로 표시되는 기체연료 1 N㎥가 완전 연소할 때 필요한 공기량 N㎥ 계산하시오.


프로판가스 1 N㎥를 연소시키는데 필요한 이론공기량은 몇 N㎥인가?


메탄 3 N㎥를 연소시키는데 필요한 이론공기량은 몇 N㎥인가?
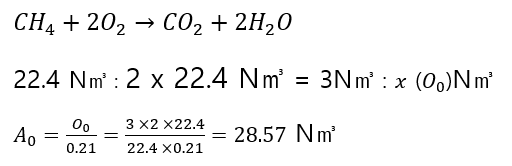

질량 기준으로 C85%,H12%, S3%의 조성으로 되어 있는 중유를 공기비 1.3으로 연소할 때에 대한 물음에 답하시오.
(1) 실제 공기량 N㎥/kg
A0=8.89C+26.67(H-O/8)+3.33
= 8.89x0.85+26.67x(0.12)+3.33x0.03 = 10.86 N㎥/kg
(2) 건연소 가스량 N㎥/kg
이론 건연소가스량
G0d = 0.79A0+1.867C+0.7S+0.8N = 0.79 x 10.86 + 1.867 x 0.85 + 0.7 x 0.03 = 10.19 N㎥/kg
실제 건연소 가스량
Gd= G0d + B = G0d + {(m-1)A0} = 10.19+{(1.3-1) x 10.86} =13.45 N㎥/kg
'에너지 관리기사' 카테고리의 다른 글
| 에너지관리기사 실기 필답유형(대류, 복사) (0) | 2023.12.20 |
|---|---|
| 에너지관리기사 실기 필답유형(대향류식) (0) | 2023.12.17 |
| 에너지관리기사 실기 필답유형(증발량) (0) | 2023.12.13 |
| 에너지 관리기사 실기 필답 유형(열전달) (0) | 2023.11.30 |
| 에너지 관리기사 실기 필답 유형(열량) (0) | 2023.11.27 |



댓글